OBESIDAD
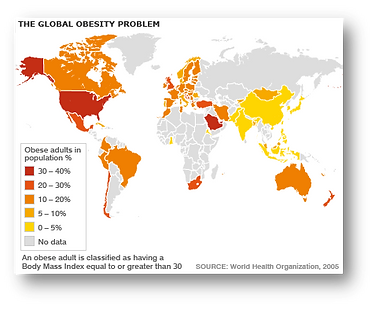
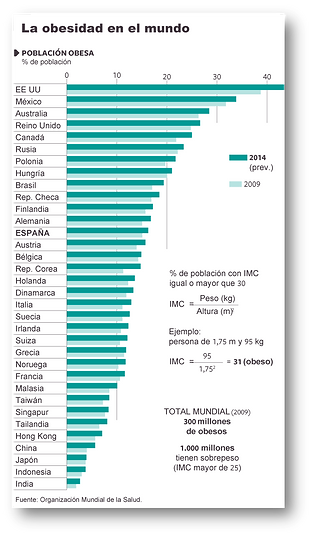
La prevalencia de la obesidad ha aumentado y continúa incrementándose de forma alarmante en nuestra sociedad, así como en países de economía en transición, adquiriendo proporciones epidémicas. En España los datos de prevalencia más recientes en adultos, obtenidos del estudio ENRICA en 2011, aportan una prevalencia de obesidad del 22,9% y de sobrepeso del 39,4% sobre una población de 12036 personas encuestadas. Los datos epidemiológicos en edad infantil española (estudio ALADINO) muestran una elevada prevalencia, presentando un 45,2% exceso de peso del cual el 26,1% corresponde a sobrepeso y el 19,1% a obesidad. Los kilos que ganan los españoles y europeos acarrean consecuencias desastrosas para la salud pública y suponen un enorme gasto económico calculado entre el 2 y el 8 por ciento del gasto sanitario. Las consecuencias más graves para la salud incluyen el desarrollo de enfermedades asociadas como la diabetes tipo 2, enfermedades cardiovasculares, ciertos tipos de cáncer, así como problemas psicosociales.
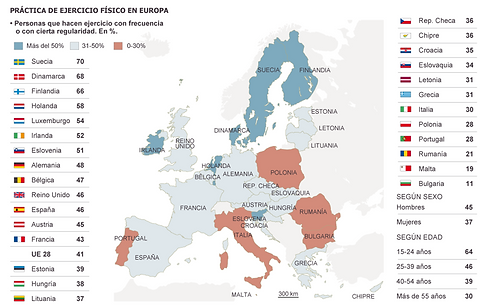
Aunque la obesidad se puede explicar por alteraciones genéticas, la actual epidemia está causada principalmente por factores externos como el estilo de vida moderno, la dieta y sobre todo, la ausencia de actividad física; así se puede definir la obesidad como una patología multifactorial que requiere un tratamiento a largo plazo incluyendo dieta y ejercicio. Hasta el momento el número de fármacos que han sido desarrollados para el tratamiento de la obesidad es muy limitado y no muy exitoso. Por esta razón, para el desarrollo de nuevos y mejores tratamientos antiobesidad, que junto con la dieta y el ejercicio contribuyan a una reducción del peso corporal, se requiere un mejor conocimiento de los mecanismos a nivel molecular que controlan el balance energético.
BALANCE ENERGÉTICO. El control de la ingesta y del peso corporal está caracterizado por una compleja interacción entre órganos periféricos implicados en la homeostasis energética como el tejido adiposo y muscular, tiroides, hígado y tracto gastrointestinal, y el sistema nervioso central (SNC). Los tejidos periféricos informan a los centros hipotalámicos reguladores del apetito sobre el estado nutricional y metabólico mediante la liberación de diversas señales circulantes como la glucosa, insulina, leptin y ghrelina entre otras (Berthoud and Morrison, 2008). Cómo el tejido adiposo funciona como almacén de energía en forma de triglicéridos, es el mayor controlador de la liberación de ácidos grasos jugando un papel crítico en el desarrollo de la resistencia a insulina en muchas situaciones patológicas. Muchos estudios han demostrado que el exceso de tejido adiposo o la acumulación ectópica de lípidos es responsable de los desórdenes metabólicos que causan la diabetes tipo II y la dislipemia. El tejido adiposo libera un amplio rango de hormonas de naturaleza peptídica o adipokinas implicadas en la regulación del metabolismo energético, y además es un gran productor de citoquinas inflamatorias relacionas con la desregulación del metabolismo en la obesidad. Las adipokinas podrían jugar un papel clave relacionando la acumulación de tejido graso y la resistencia a insulina. Entre las adipokinas ya conocidas, ej. leptina, adiponectina, retinol-binding protein-4, visfatin, adipsin, TNF-1 y interleukinas 6, 11, muy pocas se han definido como reguladoras de la sensibilidad a insulina, metabolismo y homeostasis energética. Bajo este contexto, el descubrimiento y caracterización de nuevos factores derivados del tejido adiposo está todavía en progreso.
Fetuin-A: La fetuin-A, también denominada (alpha2-Heremans-Schmid glycoprotein, AHSG) es una proteína abundante del suero (Dziegielewska et al., 1990) hasta la fecha exclusivamente producida por el hígado, la lengua, y la placenta (Denecke et al., 2003). En varios estudios, se ha demostrado que la fetuin-A actúa como un inhibidor natural del receptor tirosina-kinasa de insulina tanto en el hígado cómo en el músculo esquelético (Mathews et al., 2000). Los ratones deficientes para el gen codificador de la fetuin-A mostraron una mayor sensibilidad a insulina y fueron resistentes al aumento de peso inducido por la dieta (Mathews et al., 2002). Además de los efectos que ejerce la fetuin-A sobre el receptor de insulina en el hígado y músculo, se postula que podría estar implicada en otro mecanismo a través del cual afectaría al tejido adiposo para inducir resistencia a insulina generalizada en todo el organismo. Se ha visto que polimorfismos del gen de fetuin-A están asociados con la diabetes de tipo 2 (Siddiq et al., 2005) y afectan a la acción de la insulina sobre los adipocitos (Dahlman et al., 2004). Además, la fetuin-A se ha visto que tiene propiedades pro-adipogénicas directas (Schmidt et al., 1990), sin embargo, los mecanismos implicados en este proceso se desconocen. Más recientemente se ha mostrado que los niveles de esta proteína en el plasma humano se correlacionan con hígado graso, intolerancia a glucosa, resistencia a insulina, síndrome metabólico y el perfil lipídico aterogénico (Stefan et al., 2006; Mori et al., 2006; Ix et al., 2006). Además, Hennige y colaboradores han encontrado que la fetuin-A induce inflamación de bajo grado y reprime la producción de adiponectina en animales y humanos (Hennige et al., 2008).
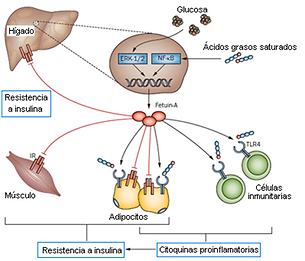
Múltiples estudios han puesto de manifiesto la relación entre obesidad e inflamación, pero artículos recientes señalan a la fetuin-A como proteína mediadora entre el exceso de lípidos y la activación del sistema inmune innato en el tejido adiposo, que tiene como última consecuencia la liberación de citoquinas y la inactivación del receptor de insulina (Pal et al., 2012; Bucci et al., 2013). Se ha observado que la fetuin-A actúa presentando los ácidos grasos libres al receptor tipo Toll 4 (TLR4). Este receptor se encuentra en las membranas de macrófagos y adipocitos, y su función fisiológica consiste en reconocer patrones moleculares de patógenos y desencadenar la respuesta inmune para luchar contra ellos. Sin embargo, se ha demostrado que TLR4 también puede activarse en ausencia de microorganismos por interacción con los ácidos grasos libres, cuando estos se encuentran en exceso y están unidos a fetuin-A. El TLR4 activado provoca a su vez la activación del factor de transcripción nuclear NF-КB, que tiene como consecuencia la expresión de citoquinas proinflamatorias. La liberación constante de estas citoquinas provoca finalmente la resistencia a insulina por parte del receptor, que conduce a la intolerancia a glucosa (Pal et al., 2012). Otro estudio posterior ha revelado un mecanismo alternativo por el cual la fetuin-A media la activación de la inflamación del tejido adiposo en respuesta a el exceso de ácidos grasos a nivel paracrino. Se ha comprobado que el exceso de lípidos en el ambiente del tejido adiposo conduce a un aumento de la expresión de fetuin-A por parte de los adipocitos. La fetuin-A es secretada al medio extracelular y actúa, en sinergia con otras moléculas, como agente quimiotáctico atrayendo al tejido adiposo a macrófagos tipo M2 (Chatterjee et al., 2013). Además, se ha observado que la fetuin-A induce la polarización de estos macrófagos M2 (con fenotipo antiinflamatorio) hacia tipo M1, que liberan citoquinas proinflamatorias. Los autores proponen que la liberación de estas moléculas en el tejido adiposo tiene un efecto paracrino inhibiendo el receptor de insulina presente en los propios adipocitos (Chatterjee et al., 2013). Así, se pone de manifiesto que la fetuin-A ejerce su acción inhibidora del receptor de insulina mediante al menos tres mecanismos diferentes: interacción directa, activación del receptor TLR4 y atracción y polarización de macrófagos (Goustin et al., 2011; Pal et al., 2012; Chatterjee et al., 2013).
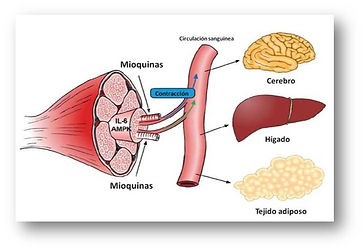
EL TEJIDO MUSCULAR COMO ÓRGANO ENDOCRINO:
Además de los órganos endocrinos clásicos, se ha visto que varios tejidos como el tejido adiposo, tienen actividad secretora de relevancia fisiológica. El papel potencial del tejido muscular esquelético como órgano endocrino se sugirió por primera vez al descubrir la expresión y secreción de la interleukina 6 (IL-6) en respuesta a la contracción muscular (Febbraio and Pedersen 2002). Bajo este contexto, Pedersen y colaboradores establecieron un nuevo paradigma al señalar que el tejido muscular es capaz de secretar factores parecidos a hormonas denominados mioquinas que podrían afectar al metabolismo de otros tejidos y órganos (Pedersen and Febbraio 2008; Pedersen 2011). Las proteínas secretadas por el músculo esquelético actuarían localmente en las células musculares de una manera autocrina/paracrina, sobre tejidos cercanos como los vasos sanguíneos del músculo, o podrían ser liberadas a la circulación produciendo efectos a nivel sistémico. En concreto, las mioquinas secretadas durante la contracción muscular podrían ejercer un papel protector contra las enfermedades asociadas al sedentarismo (Pedersen 2009).
FNDC5/IRISIN. En Enero del año 2012, el grupo de Spiegelman y colaboradores publicaron en Nature el descubrimiento de una nueva mioquina secretada por el músculo que denominaron irisin (FNDC5/irisin) (Bostrom et al., 2012). En este trabajo, describen que la secreción de irisin se induce con el ejercicio físico y depende del co-activador transcripcional PGC1alpha. Lo más relevante del trabajo es que parece ser capaz de unirse a receptores todavía desconocidos de células precursoras del tejido adiposo blanco induciendo su diferenciación a tejido adiposo pardo (TAP) en un proceso denominado “browning”. Para ello la irisin induciría la expresión de UCP-1 y otros genes asociados al TAP a través de la expresión del sensor nutricional PPARgamma. La relevancia de este hallazgo, si se confirma, es prometedora como nueva herramienta para el tratamiento de la obesidad y enfermedades asociadas al sedentarismo ya que el tejido adiposo pardo está especializado en disipar la energía en forma de calor. La diferenciación del tejido adiposo blanco en pardo inducida por la irisin mejoraría el perfil metabólico del mismo y aumentaría el gasto global energético de todo el cuerpo.
El descubrimiento de FNDC5/irisin ha causado un gran revuelo en la comunidad científica. Sin embargo, en este momento existe cierta controversia alrededor de la recién descubierta mioquina irisin y su secreción en humanos después del ejercicio así como su verdadera relación con el estatus metabólico (Timmons et al., 2012; Moreno-Navarrete et al., 2013). Estudios muy recientes, entre ellos de nuestro grupo, muestran que al contrario de lo esperado, animales y pacientes obesos presentan niveles circulantes de esta proteína elevados en comparación con individuos sanos (Huh, Panagiotou et al. 2012; Stengel, Hofmann et al. 2012) sugiriendo una resistencia a esta hormona en estos casos de índice de masa corporal (IMC) incrementado (Roca-Rivada., et al. 2013; Crujeiras et al., 2014; Pardo et al., 2014). Así, tras la publicación del primer trabajo describiendo la existencia de esta mioquina, varios autores cuestionamos la verdadera naturaleza de la forma secretada de FNDC5. Nuestro grupo, especializado en los últimos años en la caracterización de nuevas señales liberadas por el tejido adiposo y muscular (Roca-Rivada et al., 2011; Roca-Rivada et al., 2012), ha sido recientemente pionero en el estudio de la secreción directa de irisin a partir de explantes de tejido muscular in Vitro (Roca-Rivada, et al. 2013). Nuestro trabajo ha permitido aportar nueva información sobre el modo de secreción de irisin al mostrar que el tejido muscular esquelético es capaz de secretar una forma similar a la descrita en Nature de 25kDa usando anticuerpos tanto contra la parte intracelular como extracelular de la proteína. Estos resultados sugieren que la forma secretada podría corresponderse a la proteína completa. En este trabajo además describimos diferencias de secreción de irisin en función del tipo muscular; así mostramos por primera vez que el tejido muscular compuesto por fibras de tipo oxidativas-lentas secreta un 40% más irisin que el formado por fibras glicolíticas-rápidas. Teniendo en cuenta que con el entrenamiento físico aumentan las fibras de tipo oxidativo, nuestros resultados confirmarían el nexo de unión entre ejercicio y secreción de irisin. Así, en ambos tipos musculares encontramos que la secreción de esta mioquina aumenta tras 3 semanas de ejercicio tal y como había descrito Spiegelman in vivo con roedores (Bostrom, Wu et al. 2012).
FNDC5/IRISIN NO ES SÓLO UNA MIOQUINA, SINO TAMBIÉN UNA ADIPOKINA:
Bajo el contexto anterior, durante la caracterización de la secreción de irisin a partir del tejido muscular, nuestro grupo ha establecido un nuevo paradigma en relación a la FNDC5/irisin al descubrir que esta mioquina está también expresada y secretada por adipocitos del tejido adiposo blanco en ratas y humanos, y por lo tanto puede comportarse como una adipoquina (Roca-Rivada et al., 2013). En concreto, nuestros primeros resultados con estudios de secreción directa a partir de explantes de rata muestran que el tejido adiposo visceral, y en especial el subcutáneo expresan y secretan FNDC5. En comparación con el tejido muscular, encontramos que el tejido adiposo subcutáneo secreta un 20% y el visceral un 40% menos irisin que el músculo de tipo oxidativo más secretor bajo condiciones normales. También hemos observado que el tejido adiposo aumenta la secreción de FNDC5/irisin tras periodos de ejercicio físico moderados, pero más cortos que en el músculo, mientras que el ayuno la disminuye. Consecuentemente, el tejido adiposo de animales anoréxicos apenas mostraron secreción de esta proteína, mientras que el procedente de animales obesos secretó significativamente más FNDC5/irisin que los animales control. Estos resultados fueron también confirmados a nivel circulante demostrando que al contrario de lo esperado, los animales obesos mostraban niveles muy elevados de esta proteína. Así, postulamos por primera vez que el tejido adiposo podría contribuir a la FNDC5/irisin circulante, y que esta contribución variaría en función del estatus fisiológico o la situación patológica (Roca-Rivada., et al. 2013). Sugerimos que en condiciones normales sería el músculo el que participaría activamente en los niveles circulantes de irisin, mientras que en situaciones patológicas con gran adiposidad como la obesidad, sería el tejido adiposo el responsable. Estudios preliminares de nuestro grupo analizando los niveles circulantes en individuos obesos están confirmando nuestra hipótesis al correlacionarse positivamente los niveles de irisin con factores de adiposidad como el BMI, diámetro de cintura, y los Kg de masa grasa (Crujeiras et al., 2014; Pardo et al., 2014). Además, es importante destacar el reciente trabajo de Stengel y colaboradores mostrando niveles circulantes elevados en pacientes obesos en comparación con normopesos y anoréxicas, y la también correlación positiva entre irisin y peso, y masa grasa (Stengel et al., 2013). Dados lo efectos beneficiosos atribuidos a la irisin, se podría sugerir que la exposición a niveles elevados de esta proteína en los pacientes obesos podría ser responsable de una resistencia a la misma. Apoyando esta hipótesis están los trabajos que muestran que los sujetos obesos poseen porcentajes muy bajos de tejido adiposo pardo en comparación con los normopeso (Virtanen et al., 2009).